Nye 5-års data: (NSCLC)
Nye 5-års data: KEYTRUDA® viser fortsat væsentlig forbedring i overlevelse hos patienter med metastatisk ikke-småcellet lungekræft (NSCLC)
5-års-opfølgning på fase III-studierne KEYNOTE-407 og KEYNOTE-189 har vist, at KEYTRUDA® (pembrolizumab) i kombination med kemoterapi som 1. linjebehandling fortsat gav en væsentlig forbedring i samlet overlevelse (OS) [KEYNOTE-407: HR=0,71; 95% CI, 0,59 til 0,85 og KEYNOTE-189: HR=0,60; 95% CI, 0,50 til 0,72] og progressionsfri overlevelse (PFS) [KEYNOTE-407: HR=0,62; 95% CI, 0,52 til 0,74 og KEYNOTE-189: HR=0,50; 95% CI, 0,42 til 0,60] efter 5 år hos patienter med metastatisk ikke-småcellet lungekræft (NSCLC) sammenlignet med kemoterapi alene uanset PD-L1-udtryk.1,2,3
Den objektive responsrate (ORR) og den mediane responsvarighed (DOR) var også væsentlig højere hos patienter behandlet med KEYTRUDA® i kombination med kemoterapi end hos patienter behandlet med kemoterapi alene uanset PD-L1-status [KEYNOTE-407: ORR = 62,2 % vs. 38,8 %; DOR = 9,0 vs. 4,9 måneder. KEYNOTE-189: ORR = 48,3 % vs. 19,9 %; DOR = 12,7 vs. 7,1 måneder]. Den mediane progressionsfri overlevelse på næste behandling (PFS2) var ligeledes længere i KEYTRUDA®-armen end i kontrolarmen [KEYNOTE-407: HR=0,60; 95% CI, 0,50 til 0,72 og KEYNOTE-189: HR=0,54; 95% CI, 0,45 til 0,65], og forekomsten af bivirkninger var sammenlignelig i de to arme. Resultaterne for patienter, der fik over 35 behandlingsserier, understøtter en behandlingsvarighed på 2 år.2,3
Indikation: KEYTRUDA®, i kombination med carboplatin og enten paclitaxel eller nab-paclitaxel, er indiceret til førstelinjebehandling af metastatisk planocellulær NSCLC hos voksne.KEYTRUDA® (pembrolizumab) i kombination med pemetrexed og platinbaseret kemoterapi er indiceret til førstelinjebehandling af metastatisk ikke-planocellulær NSCLC hos voksne uden EGFR- eller ALK-positive mutationer i tumorer.1
Markant længere OS og PFS efter 5 år ved KEYTRUDA®
5-års opfølgningen på fase III-studiet KEYNOTE-407 havde en median opfølgningstid på 56,9 måneder (interval: 49,9 til 66,2). Resultaterne viste, at hos patienter med planocellulær ikke-småcellet NSCLC var 5-års overlevelsesraten næsten dobbelt så høj i KEYTRUDA®-armen (18,4 %) som i kontrolarmen (9,7 %) [HR=0,71; 95% Cl, 0,59 til 0,85]. Den 5-års PFS var 10,8 % i KEYTRUDA®-armen og 3,5 % i kontrolarmen [HR=0,62; 95% Cl, 0,52 til 0,74]. Forbedringen i 5-års OS og 5-års PFS blev observeret på tværs af alle PD-L1 subgrupper.2
Figur 1: Kaplan-Meier-kurve for samlet overlevelse (OS) i KEYNOTE-407 (intent to treat-population)
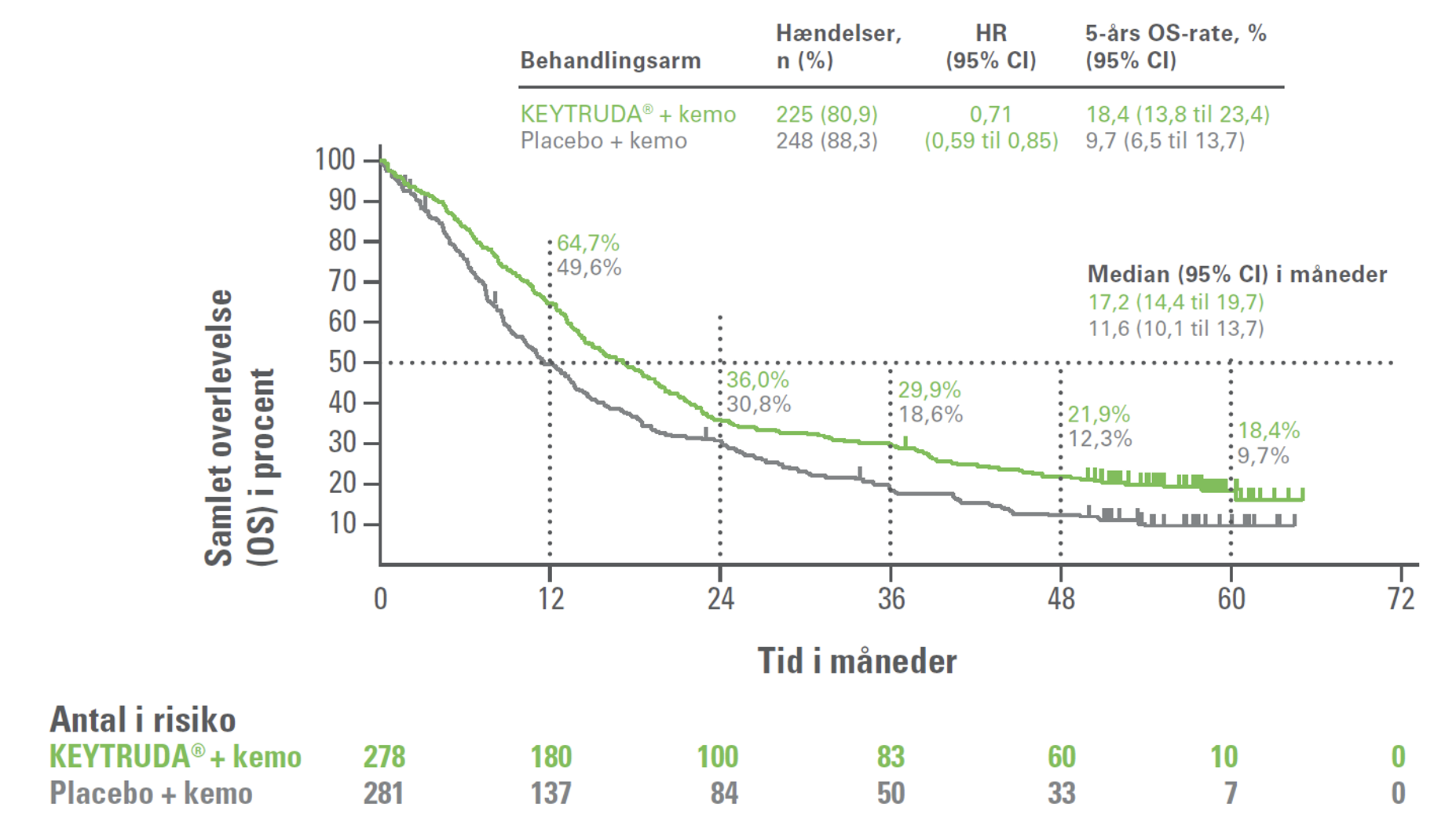
Figur 1A i Novello et al.2 (adapteret af MSD)
Figur 2: Kaplan-Meier-kurve for progressionsfri overlevelse (PFS) i KEYNOTE-407 (intent to treat-population)
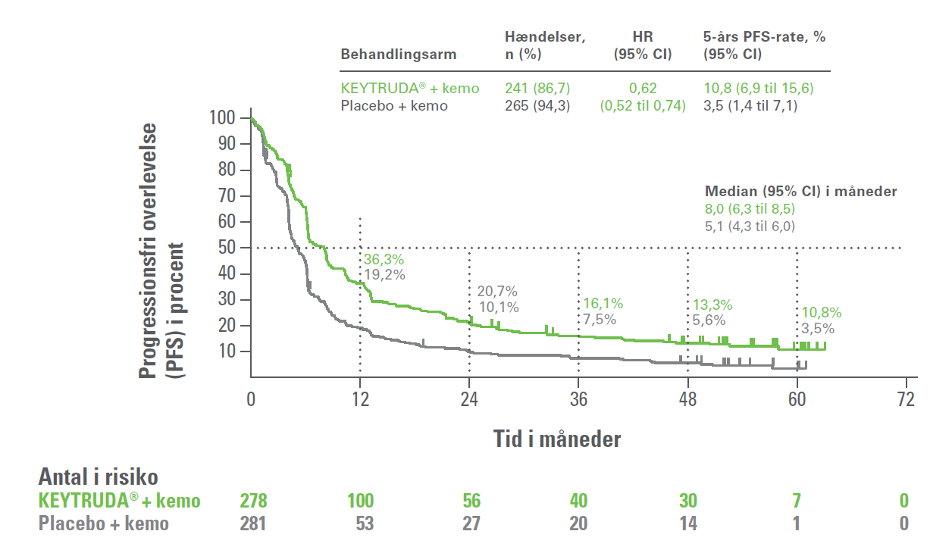
Figur 1E i Novello et al.2 (adapteret af MSD)
5-års opfølgningen på fase III-studiet KEYNOTE-189 viste, med en median opfølgningstid på 64,6 måneder (interval: 60,1 til 72,4), at hos patienter med metastatisk ikke-planocellulær NSCLC uden EGFR- eller ALK-mutation var 5-års overlevelsesraten væsentlig højere i KEYTRUDA®-armen (19,4 %) end i kontrolarmen (11,3 %) [HR=0,60; 95% Cl, 0,50 til 0,72]. 5-års PFS var 7,5 % i KEYTRUDA®-armen og 0,6 % i kontrolarmen [HR=0,50; 95% Cl, 0,42 til 0,60]. Forbedringen i 5-års OS og 5-års PFS blev observeret på tværs af alle PD-L1 subgrupper.3
Figur 3: Kaplan-Meier-kurve for samlet overlevelse (OS) i KEYNOTE-189 (intent to treat-population)
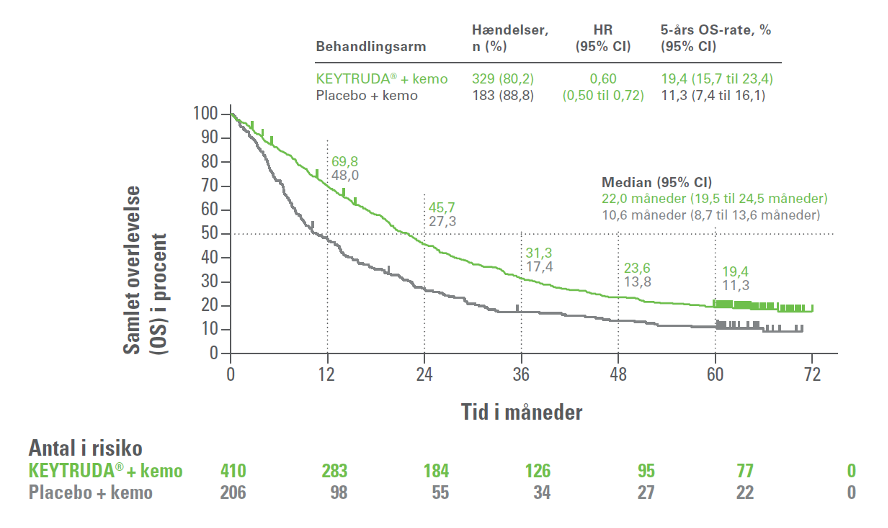
Figur 1A i Garassino et al.3 (adapteret af MSD)
Kaplan-Meier-kurve for progressionsfri overlevelse (PFS) i KEYNOTE-189 (intent to treat-population)
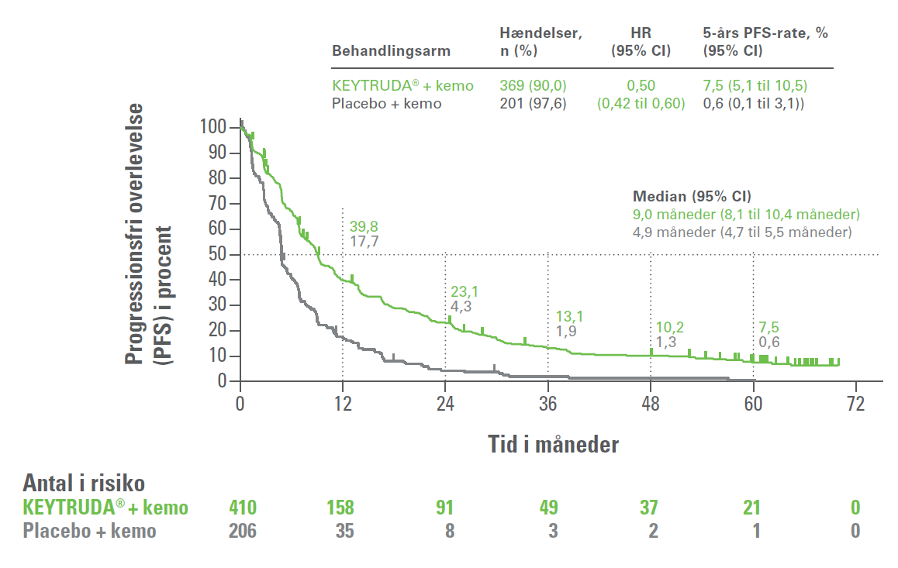
Figur 1E i Garassino et al.3 (adapteret af MSD)
Forbedret ORR, DOR og PFS2 med KEYTRUDA®
Ved 5-års opfølgningen blev det desuden vist, at patienter med planocellulær NSCLC (KEYNOTE-407) havde en væsentligt højere ORR og median DOR i KEYTRUDA®-armen end i kontrolarmen uanset PD-L1-status: ORR var 62,2 % i KEYTRUDA®-armen (95% Cl, 56,2 til 68,0) sammenlignet med 38,8 % i kontrolarmen (95% Cl, 33,1 til 44,8), og den mediane DOR var 4,1 måneder længere i KEYTRUDA®-armen (9,0 måneder) end i kontrolarmen (4,9 måneder). Den mediane PFS2 var ligeledes længere i KEYTRUDA®-armen end i kontrolarmen [HR=0,60; 95% Cl, 0,50 til 0,72]. 5-års PFS2-raten var 18,1 % (95% CI, 13,6 til 23,1) i KEYTRUDA®-armen sammenlignet med 7,1 % (95% CI, 4,4 til 10,7).2
Samme billede tegnede sig for 5-års opfølgningen af KEYNOTE-189: Hos patienter med metastatisk ikke-planocellulær NSCLC uden EGFR- eller ALK-mutation var ORR og den mediane DOR markant højere i KEYTRUDA®-armen end i kontrolarmen uanset PD-L1-status: ORR var 48,3 % i KEYTRUDA®-armen (95% Cl, 43,4 til 53,2) sammenlignet med 19,9 % i kontrolarmen (95% Cl, 14,7 til 26,0). Den mediane DOR var 5,6 måneder længere i KEYTRUDA®-armen (12,7 måneder) end i kontrolarmen (7,1 måneder). Median PFS2 var ligeledes længere i KEYTRUDA®-armen end i kontrolarmen [HR=0,54; 95% Cl, 0,45 til 0,65]. 5-års PFS2-raten var 16,7 % (95% CI, 13,2 til 20,5) i KEYTRUDA®-armen sammenlignet med 7,8 % i kontrolarmen (95% CI, 4,7 til 12,1).3
Resultater understøtter 2 års behandlingsvarighed
I KEYNOTE-407 var ORR hos patienter, der gennemførte 35 behandlingsserier med KEYTRUDA®, 90,9 %, og 3-års overlevelsen efter gennemførelse af de 35 serier (dvs. ca. 5 år efter randomisering) var 69,5 % (95% CI, 54,8 til 80,2). I KEYNOTE-189 var ORR hos patienter, der gennemførte 35 behandlingsserier med KEYTRUDA®, 86,0 %, og 3-års overlevelsen efter gennemførelse af de 35 serier var 71,9 % (95% CI, 58,3 til 81,8). Disse resultater understøtter en behandlingsvarighed på 2 år.
Signifikante OS- og PFS-resultater fra den endelige analyse
De nye 5-års data understøtter de signifikante overlevelsesresultater fra de endelige analyser. Den endelige analyse fra KEYNOTE-407 har med en median opfølgningstid på 14,3 måneder vist en signifikant forbedret overlevelse (OS): Median OS var 17,1 vs. 11,6 måneder [HR = 0,71; 95% Cl: 0,58-0,88, p=0,0006]. Analysen viste ligeledes en 43 % reduceret risiko for sygdomsprogression (PFS) [HR =0,57; 95% CI 0,47-0,69), p<0,0001] (median PFS: 8,0 vs. 5,1 måneder) hos patienter med planocellulær NSCLC, som fik KEYTRUDA® i kombination med platinbaseret kemoterapi sammenlignet med placebo i kombination med kemoterapi.1,4
Efter en median opfølgning på 31,0 måneder, viste den endelige analyse af KEYNOTE-189 en median OS på 22,0 måneder sammenlignet med 10,6 måneder i kontrolarmen [HR = 0,56; 95% CI: 0,46-0,69, p<0,00001]. Dertil var risikoen for sygdomsprogression (PFS) signifikant reduceret med 51 % i KEYTRUDA®-armen sammenlignet med kontrolarmen (HR = 0,49; 95% Cl: 0,41-0,59, p<0,00001].1,5
Håndterbar toksicitet og sammenlignelig bivirkningsprofil
5-års opfølgningen på KEYNOTE-407 viste desuden, at forekomsten af bivirkninger var sammenlignelig i KEYTRUDA®-armen og kontrolarmen (98,6 % vs. 98,2 %). Andelen af patienter, der oplevede en grad 3-5 bivirkning var 74,8 % i KEYTRUDA®-armen og 70,0 % i kontrolarmen. Immunmedierede bivirkninger og infusionsreaktioner af grad 3-5 forekom hos 13,3 % i KEYTRUDA®-behandlingsarmen og hos 3,2 % i kontrolarmen.2
5-års opfølgningen på KEYNOTE-189 viste også, at forekomsten af bivirkninger var sammenlignelig i KEYTRUDA®-armen og kontrolarmen (99,8 % vs. 99,0 %). Immunmedierede bivirkninger og infusionsreaktioner forekom hos 27,9 % i KEYTRUDA®-behandlingsarmen og hos 13,4 % i kontrolarmen.3
Samlet oversigt over bivirkninger for KEYTRUDA® (pembrolizumab) kan findes i det forkortede produktresumé. Se i menubaren ovenfor.
Hvis du har spørgsmål eller kommentarer er du velkommen til at kontakte:

Malene Kjørup
MSD Onkologi
malene.kjrup@merck.com
+45 20 16 28 56
Faktaboks 1:
Indikation: KEYTRUDA®, i kombination med carboplatin og enten paclitaxel eller nab-paclitaxel, er indiceret til førstelinjebehandling af metastatisk planocellulær NSCLC hos voksne1
KN-407: Studiedesign og resultater1,2
Studie: Randomiseret, dobbeltblindet, placebokontrolleret, fase III, multicenter. Population: Behandlingsnaive, voksne patienter med metastatisk planocellulært NSCLC. Intervention: Pembrolizumab 200 mg + carboplatin AUC 6 mg/ml/min + paclitaxel 200 mg/m2 eller nab-paclitaxel 100 mg/m2 i 4 serier, efterfulgt af pembrolizumab 200 mg hver 3. uge (n=278). Komparator: Placebo + carboplatin AUC 6 mg/ml/min + paclitaxel 200 mg/m2 eller nab-paclitaxel 100 mg/m2 i 4 serier, efterfulgt af placebo hver 3. uge (n=281). Behandlingstid: Højst 24 måneder eller indtil sygdomsprogression eller uacceptabel toksicitet. Primære effektmål: Progressionsfri overlevelse (PFS) og samlet overlevelse (OS). Opfølgningstid: Median opfølgningstid 56,9 måneder1,2.
5 års PFS-resultat: Pembrolizumab + carboplatin + paclitaxel/nab-paclitaxel: Hændelse hos 10,8 %. Placebo + carboplatin + paclitaxel/nab-paclitaxel: Hændelse hos 3,5 %. HR, 0,62 [95% Cl, 0,52;0,74].2*
5 års OS-resultat: Pembrolizumab + carboplatin + paclitaxel/nab-paclitaxel: Hændelse hos 18,4 %. Placebo + carboplatin + paclitaxel/nab-paclitaxel: Hændelse hos 9,7 %. HR 0,71 [95% CI 0,59; 0,85] 2.
Faktaboks 2:
Indikation: KEYTRUDA® (pembrolizumab) i kombination med pemetrexed og platinbaseret kemoterapi er indiceret til førstelinjebehandling af metastatisk ikke-planocellulær NSCLC hos voksne uden EGFR- eller ALK-positive mutationer i tumorer. 1
KN-189: Studiedesign og resultater1,3
Studie: Randomiseret, dobbeltblindet, placebokontrolleret, fase III, multicenter. Population: Behandlingsnaive, voksne patienter med metastatisk, ikke-planocellulær NSCLC uden EGFR- eller ALK-positive mutationer i tumorer. Intervention: Pembrolizumab 200 mg + pemetrexed 500 mg/m2 + cisplatin 75 mg/m2 eller carboplatin AUC 5 mg/ml/min iv hver 3. uge i 4 serier efterfulgt af pembrolizumab 200 mg + pemetrexed 500 mg/m2 iv hver 3. uge (n=410). Komparator: Placebo + pemetrexed 500 mg/m2 + cisplatin 75 mg/m2 eller carboplatin AUC 5 mg/ml/min iv hver 3. uge i 4 serier efterfulgt af placebo + pemetrexed 500 mg/m2 iv hver 3. uge (n=206). Behandlingstid: Højst 24 måneder eller indtil sygdomsprogression eller uacceptabel toksicitet. Primære effektmål: Progressionsfri overlevelse (PFS) og samlet overlevelse (OS). Opfølgningstid: Median opfølgningstid 64,6 måneder.3
5-års PFS-resultat: Pembrolizumab + pemetrexed + platinbaseret kemo: Hændelse hos 7,5 %. Placebo + pemetrexed + platinbaseret kemo: Hændelse hos 0,6 %. HR 0,50 [95% CI 0,42;0,60]. 3
5-års OS-resultat: Pembrolizumab + pemetrexed + platinbaseret kemo: Hændelse hos 19,4 %. Placebo + pemetrexed + platinbaseret kemo: Hændelse hos 11,3 %. HR 0,60 [95% CI 0,50 til 0,72].3
Referencer
- KEYTRUDA® SPC: http://www.ema.europa.eu/en/medicines/human/EPAR/keytruda
- Novello S et al. Pembrolizumab plus Chemotherapy for Squamous Non-Small-Cell Lung Cancer: 5-year Update of the Phase III KEYNOTE-407 Study, DOI: 10.1200/JCO.22.01990 Journal of Clinical Oncology
- Garassino MC et al. Pembrolizumab Plus Pemetrexed and Platinum in Nonsquamous Non-Small-Cell Lung Cancer: 5-year Outcomes From the Phase 3 KEYNOTE-189 Study, DOI: 10.1200/JCO.22.01989 Journal of Clinical Oncology
- Paz-Ares L et al. A Randomized, Placebo-Controlled Trial of Pembrolizumab Plus Chemotherapy in Patients With Metastatic Squamous NSCLC: Protocol-Specified Final Analysis of KEYNOTE-407, DOI:10.1016/j.jtho.2020.06.015
- Rodríguez-Abreu D et al. Pemetrexed plus platinum with or without pembrolizumab in patients with previously untreated metastatic nonsquamous NSCLC: protocol-specified final analysis from KEYNOTE-189. DOI:10.1016/j.annonc.2021.04.008
KEYTRUDA® (pembrolizumab)
TERAPEUTISKE INDIKATIONER
KEYTRUDA® som monoterapi er indiceret til førstelinjebehandling af metastatisk ikke-småcellet lungecancer hos voksne, hvis tumorer udtrykker PD-L1 med tumour proportion score (TPS) ≥ 50% uden EGFR- eller ALK-positive mutationer i tumor.
KEYTRUDA®, i kombination med pemetrexed og platinbaseret kemoterapi, er indiceret til førstelinjebehandling af metastatisk ikke-planocellulær ikke-småcellet lungecancer hos voksne uden EGFR- eller ALK-positive mutationer i tumorer.
KEYTRUDA®, i kombination med carboplatin og enten paclitaxel eller nab-paclitaxel, er indiceret til førstelinjebehandling af metastatisk planocellulær ikke-småcellet lungecancer hos voksne.
KEYTRUDA® som monoterapi er indiceret til behandling af lokalt avanceret eller metastatisk ikkesmåcellet lungecancer hos voksne efter tidligere behandling med minimum én kemoterapi, og hvis tumorer udtrykker PD-L1 med TPS ≥ 1%. Patienter med EGFR- eller ALK-positive mutationer i tumor bør også have været i targeteret behandling inden behandling med KEYTRUDA®.
KONTRAINDIKATIONER: Overfølsomhed over for det aktive stof eller over for et eller flere af hjælpestofferne.
RISICI: Forsigtighed ved alvorlig eller livstruende hudreaktion under tidligere behandling med andre immunstimulerende cancerlægemidler. Forsigtighed ved urotelial cancer hos svagere patienter, der ikke er egnede kemoterapi. Kombinationsbehandling med KEYTRUDA skal anvendes med forsigtighed hos patienter ≥ 75 år. Fordelene ved KEYTRUDA skal afvejes mod risikoen for mulig GVHD.
MEGET ALMINDELIGE BIVIRKNINGER (≥1/10): Monoterapi: Anæmi, hypotyroidisme, nedsat appetit, hovedpine, dyspnø, hoste, diarré, abdominalsmerter, kvalme, opkastning, obstipation, pruritus, udslæt, muskuloskeletale smerter, artralgi, træthed, asteni, ødem, pyreksi. Kombination med kemoterapi: Anæmi, neutropeni, trombocytopeni, hypotyroidisme, hypokaliæmi, nedsat appetit, insomni, perifer neuropati, hovedpine, dyspnø, hoste, diarré, opkastning, kvalme, abdominalsmerter, obstipation, alopeci, pruritus, udslæt, muskuloskeletale smerter, artralgi, myositis, træthed, asteni, pyreksi, forhøjet alaninaminotransferase, forhøjet aspartataminotransferase. Kombination med axitinib eller lenvatinib: Urinvejsinfektion, anæmi, hypotyroidisme, nedsat appetit, hovedpine, dysgeusi, hypertension, dyspnø, hoste, diarré, abdominalsmerter, kvalme, opkastning, obstipation, udslæt, pruritus, artralgi, muskuloskeletale smerter, ekstremitetssmerter, træthed, asteni, ødem, pyreksi, forhøjet lipase, forhøjet alaninaminotransferase, forhøjet aspartataminotransferase, forhøjet kreatinin i blodet.
ALMINDELIGE BIVIRKNINGER (≥1/100 til <1/10): Monoterapi: Pneumoni, trombocytopeni, neutropeni, lymfopeni, infusionsrelaterede reaktioner, hypertyroidisme, hyponatriæmi, hypokaliæmi, hypokalcæmi, insomni, svimmelhed, perifer neuropati, letargi, dysgeusi, øjentørhed, hjertearytmi (inklusive atrieflimren), hypertension, pneumonitis, colitis, mundtørhed, hepatitis, alvorlige hudreaktioner, erytem, dermatitis, tør hud, vitiligo, eksem, alopeci, akneiform dermatitis, myositis, ekstremitetssmerter, artritis, influenzalignende sygdom, kuldegysninger, forhøjet alaninaminotransferase, forhøjet aspartataminotransferase, forhøjet alkalisk fosfatase i blodet, hyperkalcæmi, forhøjet alkalisk fosfatase i blodet, forhøjet bilirubin i blodet, forhøjet kreatinin i blodet. Kombination med kemoterapi: Pneumoni, febril neutropeni, leukopeni, lymfopeni, infusionsrelaterede reaktioner, binyrebarkinsufficiens, tyroiditis, hypertyroidisme, hyponatriæmi, hypokalcæmi, svimmelhed, dysgeusi, letargi, øjentørhed, hjertearytmi (inklusive atrieflimren), hypertension, pneumonitis, colitis, gastritis, mundtørhed, hepatitis, alvorlige hudreaktioner, erytem, dermatitis, tør hud, akneiform dermatitis, eksem, myositis, ekstremitetssmerter, artritis, akut nyreskade, ødem, influenzalignende sygdom, kuldegysninger, forhøjet bilrubin i blodet, forhøjet alkalisk fosfatase i blodet, forhøjet kreatinin i blodet, hyperkalcæmi. Kombination med axitinib eller lenvatinib: Pneumoni, neutropeni, trombocytopeni, lymfopeni, leukopeni, infusionsrelaterede reaktioner, binyrebarkinsufficiens, hypertyroidisme, tyroiditis, hyponatriæmi, hypokaliæmi, hypokalcæmi, insomni, svimmelhed, perifer neuropati, letargi, øjentørhed, hjertearytmi (inklusive atrieflimren), pneumonitis, colitis, pankreatitis, gastritis, mundtørhed, hepatitis, alvorlige hudreaktioner, dermatitis, tør hud, erytem, akneiform dermatitis, alopeci, artritis, nefritis, influenzalignende sygdom, kuldegysninger, forhøjet amylase, forhøjet bilirubin i blodet, forhøjet alkalisk fosfatase i blodet, hyperkalcæmi.
02-APR-2024
DK-KEY-00162